|
| Uma das ferramentas mais importantes de um químico. |
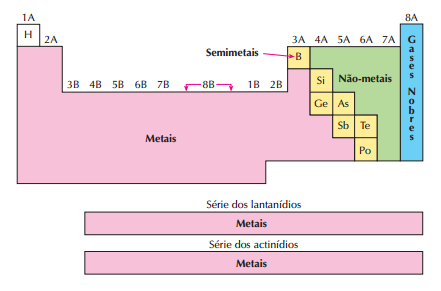
Módulo: Tabela periódica
- I - Introdução e organização da tabela periódica
- II - Propriedades periódicas e aperiódicas
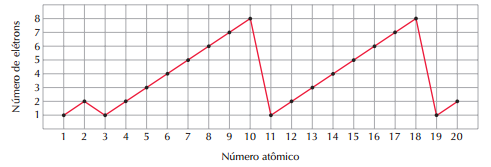
Dizemos que um fato é periódico quando um intervalo se repete de forma igual. Isto se aplica à Química. Por exemplo, se fizermos um gráfico relacionando o número de elétrons na camada de valência com o número atômico para os 20 primeiros elementos, o resultado será este:
Propriedades aperiódicas
- Massa atômica: a massa atômica cresce de acordo com o número atômico, e não de acordo com os períodos ou família. Por isso, a massa atômica é uma propriedade aperiódica;
- Calor específico: a quantidade de calor necessária para aumentar em 1º C a temperatura de 1 g do elemento diminui com o aumento do número atômico.
Propriedades periódicas
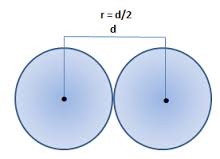
- Raio atômico: é a distância entre o núcleo do átomo e o núcleo de outro mesmo átomo. Isto dividido por dois, resulta no raio atômico. Quanto maior o período, maior o número de camadas do átomo, então, maior será o seu tamanho. E, quando se aumenta o número de elétrons de valência (a família), o número de prótons também aumenta, e ele atrai mais os elétrons, diminuindo o átomo. Ou seja: O raio atômico cresce com o aumento do período e diminui com o aumento da família.
- Energia de ionização: também chamado de potencial de ionização, determina a quantidade de energia necessária para retirar um elétron de um átomo. Metais, por se tornarem cátions facilmente, possuem baixas energias de ionização, enquanto ametais, por terem tendencia a ganhar elétrons, possuem altas energias de ionização. Os gases nobres possuem as maiores energias de ionização, já que, como eles são estáveis, é extremamente difícil tirar um elétron deles. A energia aumenta conforme aumentam o número de elétrons retirados. Ela aumenta com o aumento da família e diminui com o aumento do período.
- Eletroafinidade: chama-se eletroafinidade ou afinidade eletrônica a energia liberada quando um elétron é adicionado a um átomo neutro no estado gasoso. Esta aumenta com o aumento da família, e diminui com o aumento do período. Os gases nobres não possuem esta energia.
- Volume atômico: é o volume de 1 mol de um átomo. O volume atômico cresce periodicamente com o numero atômico, desta forma:
- Densidade absoluta: relação de massa e volume. Cresce periodicamente deste modo:
- Ponto de fusão e de ebulição: As temperaturas nas quais os elementos entram em fusão ou em ebulição são, também, funções periódicas de seus números atômicos.
 |
| O Carbono é a única exceção, com ponto de fusão de 3550 ºC, o elemento com maior ponto de fusão e ebulição. |
É interessante notar que os elementos de menores pontos de
fusão e de ebulição são aqueles que podem se apresentar no estado
líquido, ou até mesmo no gasoso, em condições ambiente.





















.jpg)